Chapitre
1
INTRODUCTION
A L'IMMUNOLOGIE
L'immunologie est la
science qui étudie les réactions induites au sein d'un organisme vivant par
l'introduction de substances étrangères à l'organisme. Les réactions non
spécifiques caractérisent l'immunité naturelle (ou innée), les réactions
spécifiques caractérisent l'immunité adaptative.
I - champs
d'application de l'immunologie en médecine
1-
La réaction immunitaire physiologique vise à éliminer les agents
étrangers à l'organisme. Elle assure donc la défense contre les
infections. On peut stimuler cette réaction immunitaire par des vaccinations
pour prévenir les infections. Le système immunitaire intervient aussi dans la défense
anti-tumorale
2- Un certain nombre de maladies peuvent résulter d'un dysfonctionnement du système immunitaire:
o soit d'un déficit de la réponse : les déficits immunitaires congénitaux, les déficits immunitaires acquis, notamment d'origine virale (SIDA)
o soit d'un excès de réponse immunitaire : au cours des maladies allergiques, la réaction immunitaire semble outrepasser son but
o soit d'une réaction immunitaire mal ciblée: ce sont les maladies auto-immunes où l'organismes déclenche une réaction immunitaire contre lui-même.
3-
Enfin, il y a un domaine de l'immunopathologie entièrement créé par
l'homme: c'est la réaction immunitaire qui entraîne le rejet des greffes.
II – Définitions
A – Antigènes, immunogènes,
haptènes, épitopes
L’induction délibérée de la réponse
immunitaire est connue sous le terme d’immunisation. Les immunisations
expérimentales sont réalisées en routine en injectant à un animal ou à un homme
une substance étrangère appelée "antigène". Afin de déterminer si la
réponse immunitaire s’est développée, et de suivre son évolution, on recherche
chez les individus immunisés l’apparition des stigmates immunologiques de la
réponse à l’antigène. La réponse immunitaire vis-à-vis de la plupart des
antigènes induit à la fois la production d’anticorps et de cellules spécifiques. L’analyse de la réponse
anticorps est effectuée sur le sérum. L’étude de la réponse cellulaire est
réalisée à partir de cellules prélevées du sang circulant ou des organes
lymphoïdes secondaires. La lourdeur des méthodes employées pour étudier la
réponse cellulaire font que son analyse est surtout restreinte à l’étude des
modèles animaux.
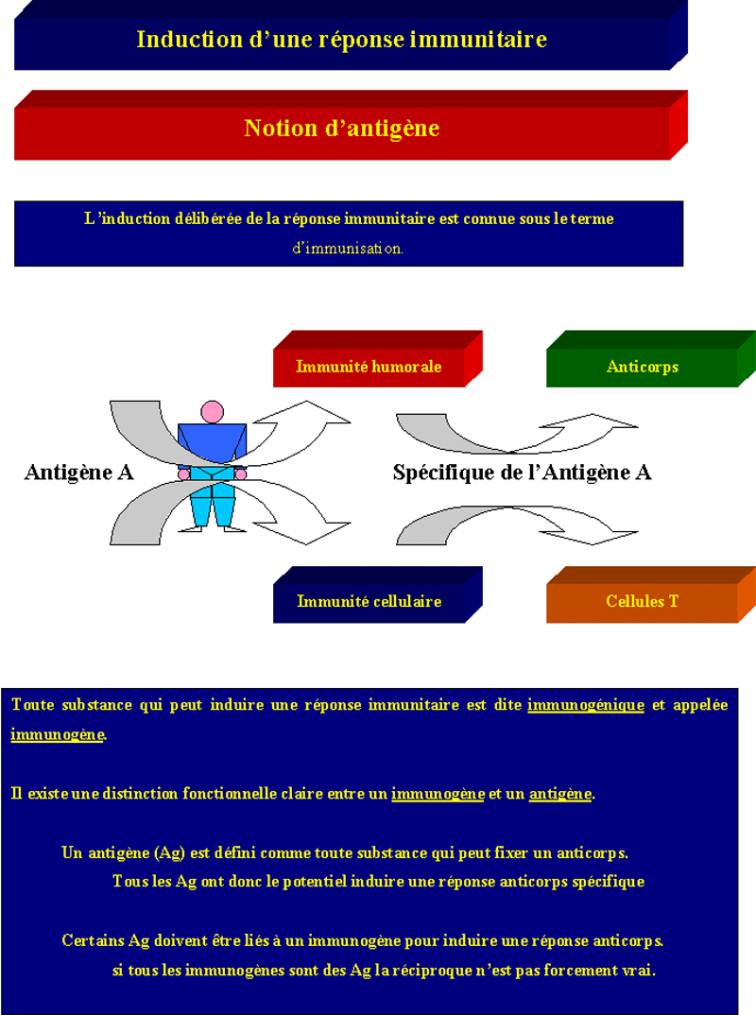
Toute substance qui
peut induire une réponse immunitaire est dite immunogénique et appelée immunogène.
Il existe une distinction fonctionnelle claire entre un immunogène et un
antigène.
Un immunogène est
capable de susciter l'apparition d'un anticorps spécifique et de se combiner à
lui.
Un antigène est
défini comme toute substance qui peut se combiner à un anticorps spécifique
mais qui n'est pas capable de l'induire. Un antigène incapable d'induire une
réponse immunitaire est un haptène. Il peut devenir immunogénique
lorsqu'on le couple à une protéine porteuse.
Figure 1 : Notion
d’antigène
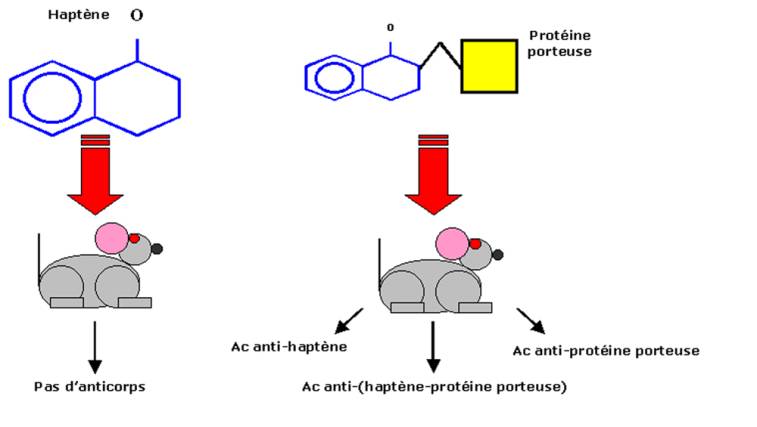
C’est Landsteiner qui, au début du siècle étudia la variété des anticorps pouvant être produits en réponse à une stimulation antigénique. Le modèle expérimental utilisé consistait en l’immunisation d’animaux avec des petites molécules organiques comme les radicaux nitrophényl. Bien que ces structures simples soient incapables d’induire directement une réponse anticorps, Landsteiner montra que la fixation covalente de protéines porteuses à ces structures simples permettait de déclencher une réponse immunitaire. Les molécules chimiques nécessitant l’adjonction de protéines porteuses pour devenir immunogèniques furent appelées « haptènes ». Des animaux immunisés avec ces complexes haptène-protéines porteuses produisent trois types distincts d’anticorps. Le premier correspond à des anticorps anti-haptène. Le second est spécifique de la protéine porteuse et le troisième reconnaît à la fois les deux constituants du complexe. La fixation des anticorps dirigés contre un haptène particulier est spécifique, c’est à dire que ces anticorps sont incapables de reconnaître un autre haptène même si sa structure chimique est très proche. L’étude de ce type de réaction haptène/anticorps anti-haptène a joué un grand rôle dans la connaissance du mode de fixation d’un anticorps sur un antigène. Les anticorps anti-haptène jouent aussi un rôle en pathologie puisqu’ils sont responsables des réactions allergiques aux pénicillines et à divers autres médicaments.
Une molécule
antigénique peut avoir une structure très complexe et comporter plusieurs sites
reconnus par des anticorps différents. Chaque site ou déterminant
antigénique fixant un anticorps est appelé épitope. Un épitope peut
être déterminé par la structure primaire de la chaîne peptidique qui le porte
(séquence des acides aminés), par la structure secondaire (replis et boucles de
la chaîne peptidique), la structure tertiaire ou la structure quaternaire
(rapprochement de différentes chaînes). Un épitope peut donc être constitué par
le rapprochement dans l'espace de plusieurs acides aminés qui ne se suivent pas
sur la chaîne peptidique: ce sont des épitopes conformationnels qui
disparaissent quand l'antigène est dénaturé.
Figure 2 : réponse anti-haptène.
B – Xéno-antigènes, allo-antigènes, auto-antigènes
Lorsque
une structure antigénique est propre à une espèce et distribué de façon
homogène dans l'espèce, on dit qu'il s'agit d'un antigène isotypique ou
d'un xéno-antigène.
Lorsqu'un
antigène n'est pas distribué d'une façon homogène dans une espèce, certains
individus l'expriment, mais d'autres non. Il s'agit d'un antigène allotypique
ou d'un allo-antigène.
Lorsqu'une structure antigénique est portée Il permet de différencier les individus d'une même espèce les uns des autres. Exemples: les allo-antigènes des groupes sanguins.
Les anticorps survenant après une
immunisation reconnaissent donc généralement des xéno- ou des allo-antigènes.
Il existe aussi des anticorps qui reconnaissent des antigènes au sein même de
l'organisme qui les produit: ce sont des auto-anticorps, qui se fixent sur des auto-antigènes.
Certains des ces anticorps existent physiologiquement (auto-anticorps
naturels), les autres apparaissent au cours des maladies auto-immunes.
C – Influence de la dose, de la forme et de la voie d’administration de l’antigène dans l’induction d’une réponse immunitaire
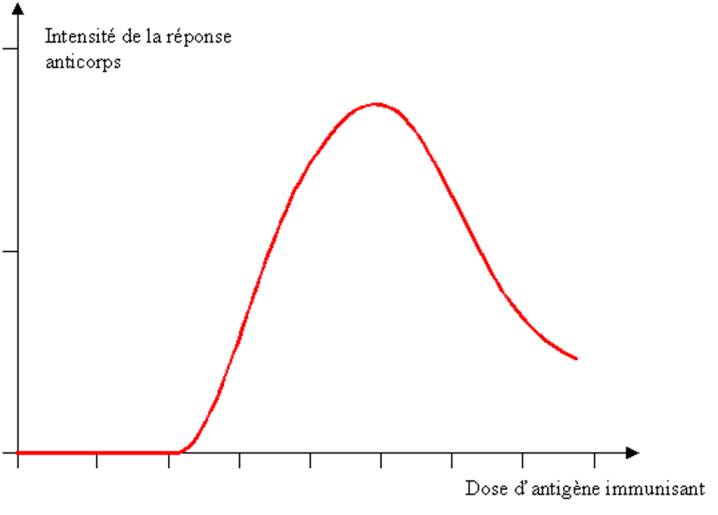
1- L’amplitude de la
réponse immunitaire dépend de la dose d’antigène administrée. Au-dessous
d’un certain seuil, la plupart des protéines immunogéniques sont incapables
d’induire une réponse immunitaire. Au-dessus de ce seuil, on observe une
augmentation progressive de l’intensité de la réponse immunitaire à mesure que
la dose d’antigène augmente. A partir d’une certaine dose on atteint un plateau
et enfin si la dose augmente encore, on observe paradoxalement une inhibition
de la réponse immunitaire. Cette inhibition s’explique par la mise en jeu de
systèmes périphériques de régulation du système immunitaire. Ces systèmes
permettent d’éviter qu’une trop forte lymphocytaire n’entraîne des effets
pervers capables d’altérer l’intégrité physique de l’organisme.
Figure 3 : Influence de la dose
d’antigène sur l’intensité de la réponse humorale spécifique
2- La forme physique
et la structure de l’antigène influencent aussi l’induction de la réponse
immunitaire. Ainsi, un antigène agrégé sera plus immunogène car cette forme
favorise la phagocytose de l’antigène par les cellules chargées de présenter
les antigènes aux lymphocytes.
3- La voie
d’administration de l’antigène affecte aussi l’amplitude et le type de réponse
immunitaire mise en jeu. Les antigènes injectés par voie sous cutanée ou
intradermique induisent les réponses les plus fortes alors que ceux injectés
directement dans la circulation sanguine ont plutôt tendance à induire un état
de non réponse du système immunitaire. Ces considérations de voie
d’administration sont à relier avec les doses d’antigène immédiatement
disponibles dans l’organisme après l’injection. Les voies sous-cutanée et
intradermique favorisent la libération lente et progressive de l’antigène dans
un lieu riche en cellules présentatrices d’antigène alors que l’injection
parentérale directe induit des concentrations sériques d’antigène élevées qui
peuvent dépasser le seuil de tolérance du système immunitaire et induire un
état de non-réponse.
Tableau 1 : Influence de la forme
physique de l’antigène
Facteurs influençant
l’immunogénicité des protéines
|
||
Paramètres
|
+
Immunogénicité |
- Immunogénicité |
|
Taille |
Grosse (>2500 kd) |
Petite (<2500 kd) |
|
Dose |
Intermédiaire
|
Faible ou forte |
|
Voie d’administration |
SC > IP >
IV
|
|
|
Forme physique |
Particulaire |
Soluble |
|
Dénaturée |
Native |
|
|
Origine |
Protéine du non soi |
Protéine du soi |
|
Adjuvant |
Présence |
Absence |
Rôle
des adjuvants
La plupart des protéines sont faiblement immunogéniques
lorsqu’elles sont administrées directement sous forme native. Une réponse
immunitaire forte contre une protéine antigénique nécessite que l’antigène soit
injecté de façon concomitante avec des adjuvants. Un adjuvant est par
définition une substance qui permet d’augmenter l’immunogénicité d’une protéine
qui lui est associée. Les adjuvants diffèrent des protéines porteuses car ils
ne forment pas de liaisons covalentes avec l’antigène.
Les adjuvants peuvent augmenter l’immunogénicité d’une
protéine de plusieurs façons. Premièrement, les adjuvants convertissent une
protéine antigénique soluble en antigène particulaire, forme dont sont
particulièrement friandes les cellules présentatrices de l’antigène. Le second
rôle des adjuvants est d’induire une inflammation locale permettant l’afflux
des cellules présentatrice de l’antigène. Cette action est due à la présence
dans l’adjuvant, de composés bactériens. Enfin, le troisième rôle de l’adjuvant
tient dans sa forme physique huileuse qui, lorsque la préparation antigénique
est administrée sous la peau, entraînent un relargage lent et progressif de
l’antigène, favorisant ainsi la stimulation du système immunitaire. L'adjuvant
le plus utilisé en immunologie expérimentale est l'adjuvant de Freund.
Tableau 2 : Rôle des adjuvants
|
Différents
types d’adjuvants |
||
Dénomination
|
Composition
|
Mécanisme
d’action
|
|
Adjuvant incomplet de Freund |
Emulsion huile/eau |
- Retarde la diffusion de
l’antigène - Favorise la prise en charge de
l’antigène par les macrophages |
|
Adjuvant complet de Freund |
Emulsion huile/eau Mycobactéries tuées |
Identique à l’AIF + co-stimulation des
macrophages. |
|
Alun |
Gel d’hydroxyde d’Aluminium |
- Retarde la diffusion de l’antigène - Favorise la prise en charge de
l’antigène par les macrophages |
|
Complexes immuno-stimulants |
Matrice de QuilA |
- incorporation d’antigènes dans
le cytosol. - Favorise l’induction d’une
réponse cytotoxique. |
III - Les instruments
de la réponse immunitaire adaptative
Les cellules immuno-compétentes
dérivent toutes de la moelle osseuse. On peut les classer en cellules
présentatrices d'antigènes (CPA) et en cellules lymphoïdes. Les cellules
présentatrices professionnelles (monocytes, macrophages, cellules dendritiques)
phagocytent les antigènes et les traitent pour qu'ils deviennent capables de
stimuler les cellules lymphoïdes. Les cellules lymphoïdes se répartissent en
deux grandes populations: les lymphocytes T et les lymphocytes B. Ces deux
populations se distinguent par leur origine, des caractéristiques phénotypiques
et des caractéristiques fonctionnelles. Les lymphocytes T sont responsables
de l'immunité à médiation cellulaire; les lymphocytes B sont responsables de
l'immunité humorale et de la production des anticorps.
Figure 4 : Différenciation des cellules
hématopoïétiques dans la moelle.
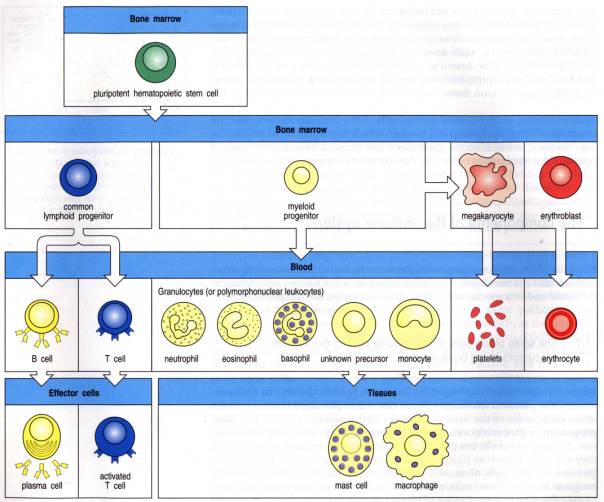
Photo : Immunobiology, 1998, CA. Janeway. Ed
Garland Publishing
A - Origine des cellules lymphoïdes
Les deux populations
naissent dans la moelle osseuse, mais les précurseurs des lymphocytes T
migrent dans le thymus pour y mûrir et y acquérir leur immuno-compétence,
tandis que les lymphocytes B mûrissent dans la moelle osseuse.
B - Phénotype
Les lymphocytes T sont caractérisés par la présence sur leur membrane, de "marqueurs" comme la molécule CD3 ("Cluster de différenciation" 3). D'autres marqueurs permettent de distinguer au sein des lymphocytes T deux sous-populations : lymphocytes Th (T "helper" ou T "auxiliaires") porteurs du marqueur CD4 et lymphocytes Tc (T" cytotoxiques") porteurs du CD8. De même, parmi les lymphocytes B, on distingue les lymphocytes B 1a, B1b et B2. Tous les lymphocytes B sont reconnus par la présence d'immmunoglobulines sur leur membrane.
C - Fonctions des cellules immuno-compétentes
La fonction principale
des lymphocytes est la reconnaissance des déterminants antigéniques ou épitopes
grâce à des récepteurs spécifiques d'antigènes: le TCR ("T cell
receptor") sur les lymphocytes T, et le BCR ("B cell receptor")
sur les lymphocytes B. Chaque lymphocyte a une spécificité restreinte à un
seul épitope. Les lymphocytes T ne peuvent reconnaître que des épitopes
peptidiques primaires présentés par les CPA. Les lymphocytes B peuvent
reconnaître les épitopes primaires ainsi que les épitopes conformationnels
présents sur les molécules antigéniques complexes.
1
– L'immunité à médiation cellulaire
Les lymphocytes T
jouent un rôle prépondérant. Les lymphocytes T CD4+ permettent la stimulation et
l'activation d'autres populations lymphoïdes, notamment les lymphocytes T
cytotoxiques (Tc) CD8+ et les lymphocytes B. Ils peuvent aussi être à l'origine de réactions
inflammatoires locales. Les lymphocytes Tc lysent les cibles cellulaires
porteuses de l'épitope qui a activé les lymphocytes.
Figure 5 : Aspects microscopiques d’un lymphocyte.
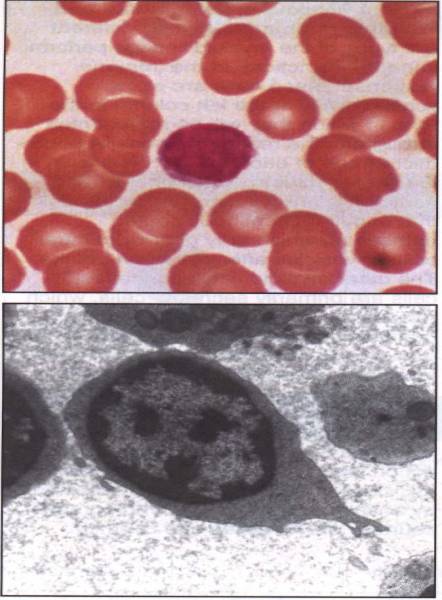
Photo : Immunobiology, 1998, CA. Janeway. Ed
Garland Publishing
La mesure de l' immunité à médiation cellulaire est difficile
à réaliser. Ceci est dû à l’absence de sécrétion de produits spécifiques de
l’antigène par les lymphocytes T. Il n’existe donc pas de méthodes simples pour
mesurer la réponse T spécifique. L’activation des lymphocytes T peut être
divisée en une phase d’induction au cours de laquelle les cellules T sont
activées, se divisent et se différencient et en une phase effectrice ou les
lymphocytes T répondent à l’agression antigénique. Chacune de ces phases
nécessite l’interaction de la cellule T avec une autre cellule présentant à sa
surface un complexe CMH-peptide spécifique du récepteur pour l’antigène du
lymphocyte T (TcR). Durant la phase d’induction, la cellule présentatrice
d’antigène délivre au lymphocyte T deux signaux. Le premier correspond à l’interaction
CHM-peptide/TcR et conditionne la spécificité de la réponse immunitaire. Le
second correspond à l'interaction de molécules de surface complémentaires sur
la CPA et le lymphocyte T appelées molécules de costimulation. Les signaux de
costimulation délivrés au lymphocyte T par la CPA induisent la prolifération de
la cellule T. Durant la phase effectrice, la nature de la cellule cible dépend
du type de cellules T effectrices préalablement stimulés.
La présence de cellules T ayant répondu à
une stimulation antigénique in vivo
est détectée par une réaction de prolifération in vitro en présence de l’antigène immunisant. Cependant, la
prolifération des lymphocytes T indique seulement que ces cellules, capables de
reconnaître un antigène donné, ont été préalablement activées in vivo, elle ne révèle pas quel type de
fonction effectrice elles remplissent. Les fonctions effectrices des
lymphocytes T sont testées par les effets qu’elles induisent lorsqu’elles sont
mises en contact avec une cellule cible appropriée. Ainsi, les lymphocytes T
CD8+ cytotoxiques peuvent tuer des cellules cibles infectées prévenant ainsi la
réplication des micro-organismes intracellulaires. Au contraire, les
lymphocytes T CD4+ n’induisent pas d’effet direct mais sont capables, par l’intermédiaire
des cytokines qu’ils sécrètent, d’activer les lymphocytes B et les macrophages
qui vont alors défendre de façon adaptée l’organisme contre divers types
d’agression.
2
– L'immunité humorale
Les lymphocytes B
contribuent à la réponse immunitaire adaptative en produisant des anticorps. La
réponse des cellules B après injection d’un immunogène est habituellement
mesurée par la production d’anticorps spécifiques de l’antigène dans le sérum
ou dans le plasma. La réponse humorale se caractérise par la spécificité, le
titre, et la classe (ou isotype) des anticorps produits. La spécificité
détermine la capacité de l’anticorps de distinguer l’immunogène des autres
antigènes. Le titre des anticorps peut être déterminé par de nombreuses
méthodes et dépend du nombre de cellules B stimulées, du taux de synthèse de
l’anticorps par les lymphocytes B et de la persistance de l’anticorps dans le
sérum après sa production. La persistance d’un anticorps dans un fluide
extracellulaire dépend de son isotype, chaque isotype ayant une demi-vie
différente in vivo. Tous ces
paramètres de la réponse humorale permettent de prévoir si la réponse anticorps
va permettre de protéger l’organisme contre une infection.
D - Autres cellules impliquées dans la réponse immunitaire
Les cellules présentatrices d'antigènes "professionnelles" sont les macrophages et les cellules dendritiques, ainsi que les autres phagocytes mononucléés tels que les cellules de Kuppfer du foie, les cellules de Langherans de la peau et les cellules de la microglie. D'autres cellules, comme les lymphocytes B et les cellules épithéliales exprimant des antigènes HLA de classe II après activation, peuvent occasionnellement présenter des antigènes aux lymphocytes T.
En
outre, les polynucléaires éosinophiles interviennent dans la défense
anti-parasitaire, et les mastocytes jouent un rôle primordial dans les réaction
allergiques immédiates.
Figure 6 : Cellules présentatrices d’antigène.
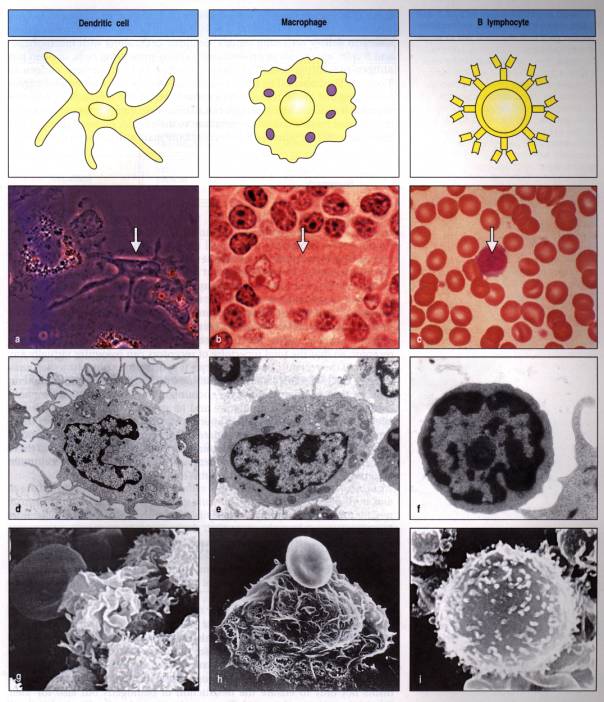
Photo : Immunobiology, 1998, CA. Janeway. Ed
Garland Publishing
IV - Les organes
lymphoïdes
Le thymus et la moelle osseuse constituent les organes lymphoïdes primaires (ou centraux) où sont sélectionnées, mûrissent et se différencient des cellules lymphoïdes.
A – Structure des organes lymphoïdes centraux
1- Le thymus
Le
thymus dérive des troisième et quatrième fentes branchiales, et est situé dans
la partie supérieure du médiastin antérieur. Il est volumineux chez l'enfant et
involue progressivement jusqu'à la puberté sans disparaître complètement ni
anatomiquement ni fonctionnellement. Il est divisé en lobes qui comportent une
zone corticale et une zone médullaire. La maturation et la différenciation des
thymocytes s'opèrent de la corticale vers la médullaire, au contact des
cellules épithéliales thymiques, des cellules dendritiques et des macrophages.
Certaines cellules épithéliales sont agencées pour former les corpuscules de
Hassal dans la zone médullaire. Au cours de ces contacts s'opèrent différentes
sélections des thymocytes qui déterminent le répertoire des TCR. Seuls les
thymocytes différenciés en lymphocytes Th CD4+ et Tc CD8+ quittent le thymus
pour circuler et coloniser les organes lymphoïdes périphériques.
Figure 7 : Structure du thymus.
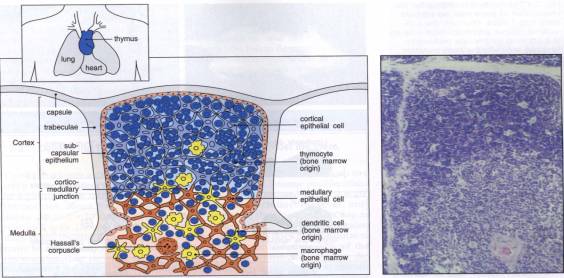
Photo : Immunobiology, 1998, CA. Janeway. Ed
Garland Publishing
2 – La moelle
osseuse hématopoïétique
Les mammifères ne possèdent pas d’organe spécialisé
dans la lymphopoïèse B. Les cellules B se développent à partir des cellules
souches lymphoïdes dans le tissu hématopoïétique du foie fœtal à partir de 8 à
9 semaines de gestation chez l’homme et vers le 14ème jour chez la
souris. Le foie fœtal est ensuite relayé par la moelle osseuse qui conserve
cette fonction chez l’adulte. Les cellules B ne sont pas produites dans un
compartiment particulier de la moelle osseuse.
B – Structure des organes lymphoïdes périphériques
La rate et les ganglions
sont les organes lymphoïdes périphériques (ou secondaires). Fonctionnellement,
la rate joue le rôle d'un gros ganglion branché sur la grande circulation. Dans
les organes lymphoïdes périphériques, les antigènes sont captés et présentés
aux cellules lymphoïdes par les CPA. Les cellules lymphoïdes spécifiques activées
prolifèrent, se différencient, coopèrent les unes avec les autres pour
développer la réponse immunitaire spécifique.
Figure 8 : Le réseau lymphatique.
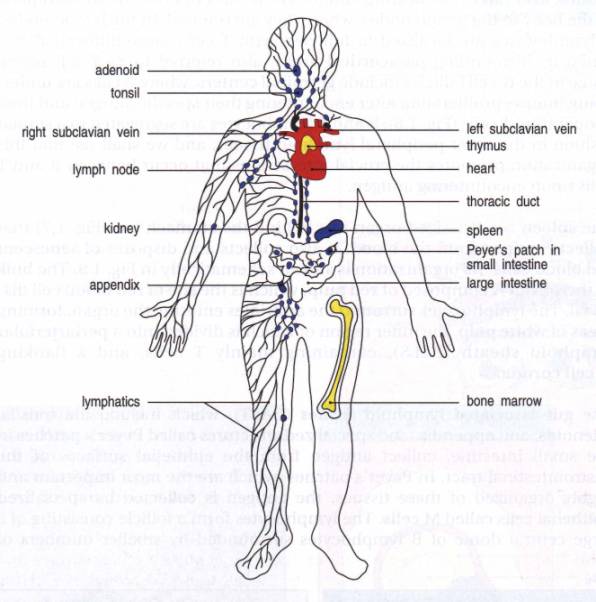
Photo : Immunobiology, 1998, CA. Janeway. Ed
Garland Publishing
1 - Les
ganglions lymphatiques
Les ganglions lymphatiques drainent la lymphe en provenance des tissus. Les vaisseaux lymphatiques afférents abordent le ganglion par la périphérie en débouchant dans le sinus marginal à partir duquel la lymphe progresse vers le hile. Elle traverse d'abord la zone corticale (cortex) puis la zone médullaire (médulla). Elle ressort du ganglion par le lymphatique efférent qui débouche du hile.
Le cortex contient 3 sortes de cellules réparties dans 2 structures reconnaissables en histologie: les lymphocytes T sont disposés en nappe sur la trame de réticuline du parenchyme ganglionnaire et constituent la zone paracorticale diffuse. Les lymphocytes B sont regroupés en follicules corticaux dont l'aspect varie selon leur niveau d'activité. En période de quiescence, les follicules sont de petite taille et d'aspect dense, homogène. En cas de stimulation et de réaction immunitaire, leur taille se développe et leur centre devient plus clair à cause de la présence de grandes cellules immunoblastiques résultant de la rencontre avec l'antigène. On observe aussi, au sein de la corticale ganglionnaire, les cellules dendritiques spécialisées dans la présentation des antigènes.
La
médullaire comporte des lymphocytes, des plasmocytes et des anticorps disposés
de façon apparemment aléatoire.
Figure 9 : Structure d’un ganglion lymphatique.
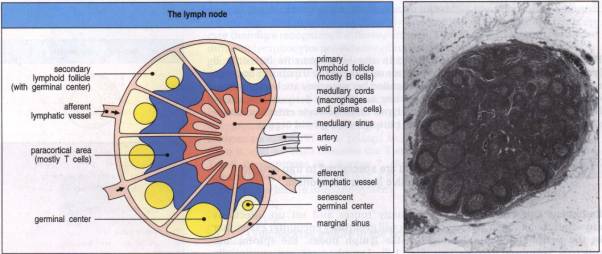
Photo : Immunobiology, 1998, CA. Janeway. Ed
Garland Publishing
2 - La rate
La rate a une structure
lymphoïde qui ressemble à celle du ganglion, mais le tissu lymphoïde splénique
est disposé autour et le long des artérioles "pénicillées" résultant
de la subdivision de l'artère splénique. Les lymphocytes forment en effet
autour des artérioles, des manchons de pulpe blanche et sont l'équivalent du
cortex ganglionnaire. Comme lui, ils comportent une zone diffuse T et des
follicules B. Entre les manchons de la pulpe blanche, on observe la pulpe rouge
qui équivaut à la médullaire des ganglions. Elle contient aussi des
lymphocytes, des plasmocytes et des macrophages. Elle est en outre le lieu
privilégié de destruction des hématies qui ont atteint la limite d'âge (120 j).
Il faut noter que dans la rate il n'y a pas de vaisseaux lymphatiques afférents
périphériques mais seulement des lymphatiques efférents hilaires.
Figure 10 : Structure de la rate.
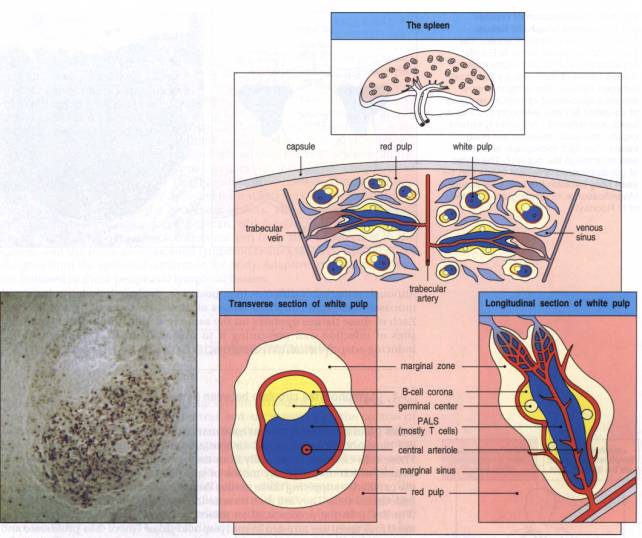
Photo : Immunobiology, 1998, CA. Janeway. Ed
Garland Publishing
3 - Les
structures lymphoïdes annexées aux muqueuses
Aux tissus épithéliaux sont annexées des formations lymphoïdes jouant le même rôle que les organes lymphoïdes secondaires: ce sont les formations lymphoïdes associées au tissu bronchique (BALT, " Bronchus associated lymphoïd tissu") et au tissu intestinal (GALT, "gut-associated lympoïd tissue").
Le
GALT comporte les amygdales, l'appendice et les formations lymphoïdes de la
sous-muqueuse intestinale appelées "plaques de Peyer". Les antigènes
traversent la barrière intestinale grâce à des cellules épithéliales
spécialisées, les cellules M, qui les captent et permettent leur transfert au
sein de la plaque de Peyer. Celle-ci est constituée d'une zone folliculaire B
entourée d'une zone T diffuse. En outre, au sein de l'épithélium intestinal,
existe une population lymphocytaire particulière (les lymphocytes
intra-épithéliaux) qui interviennent spécialement dans l'immunité muqueuse.
Figure 11 : Structure lymphoïdes associées aux
muqueuses.
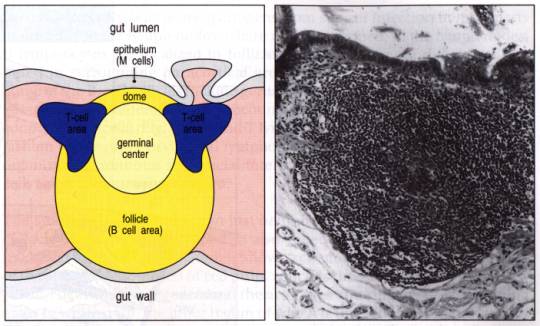
Photo : Immunobiology, 1998, CA. Janeway. Ed
Garland Publishing
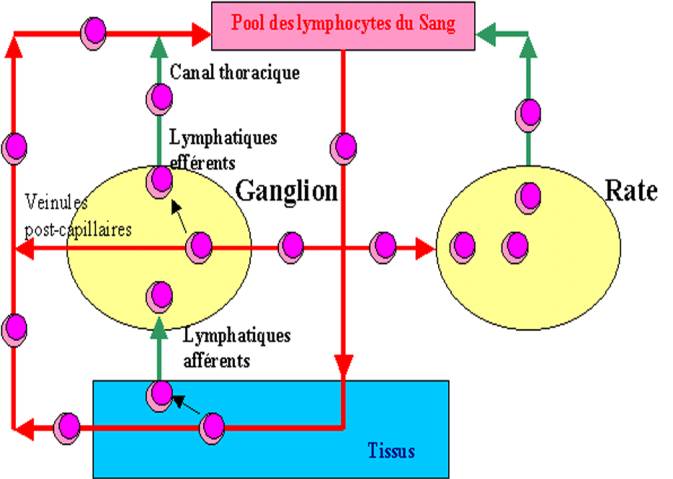
C - La recirculation des lymphocytes
Il y a un va-et-vient permanent des lymphocytes entre la circulation sanguine et la circulation lymphatique. Ils pénètrent dans les ganglions et la rate à partir des vaisseaux sanguins en traversant la paroi capillaire grâce à des cellules endothéliales spécialisées caractérisées par leur aspect cubique ("high endothelial cells"). Ils peuvent en ressortir soit par la veine efférente, soit par le lymphatique efférent qui se draîne dans le canal thoracique. Le canal thoracique débouchant dans la veine cave supérieure, les lymphocytes retournent ainsi dans la circulation sanguine.
En outre, grâce aux capillaires sanguins et aux
capillaires lymphatiques, les lymphocytes sont présents au sein de presque tous
les tissus. Les tissus les moins riches en lymphocytes sont l'oeil, le cerveau
et le testicule.
Figure 12 : Recirculation des lymphocytes.